Memahami Reaksi Redoks: Kunci Menguasai Kimia
Pengantar
Dalam dunia kimia, salah satu konsep fundamental yang harus dipahami dengan baik adalah reaksi redoks. Reaksi redoks, atau reaksi oksidasi-reduksi, merupakan salah satu jenis reaksi kimia yang memainkan peran penting dalam berbagai proses, mulai dari fotosintesis hingga pembakaran bahan bakar. Penguasaan konsep reaksi redoks tidak hanya penting dalam konteks akademik, tetapi juga memiliki aplikasi luas dalam kehidupan sehari-hari dan berbagai bidang industri.
Dalam artikel ini, kita akan mengupas tuntas secara lengkap dan jelas mengenai reaksi redoks. Kita akan membahas definisi, prinsip-prinsip dasar, serta contoh-contoh aplikasinya dalam kehidupan nyata. Dengan memahami konsep reaksi redoks secara mendalam, Anda akan memiliki pemahaman yang kuat dalam bidang kimia dan dapat menerapkannya dalam berbagai situasi.
Apa itu Reaksi Redoks?
Reaksi redoks, singkatan dari reaksi oksidasi-reduksi, adalah jenis reaksi kimia yang melibatkan perpindahan elektron dari satu zat ke zat lain. Dalam reaksi redoks, terdapat dua proses yang terjadi secara bersamaan, yaitu oksidasi dan reduksi.
Oksidasi adalah proses hilangnya elektron oleh suatu zat, sedangkan reduksi adalah proses penambahan elektron oleh suatu zat. Dengan kata lain, dalam reaksi redoks, ada zat yang melepaskan elektron (teroksidasi) dan ada zat yang menerima elektron (tereduksi).
Contoh sederhana reaksi redoks adalah pembakaran kayu. Dalam proses pembakaran, kayu (bahan bakar) teroksidasi, melepaskan elektron, dan bereaksi dengan oksigen (oksidator) yang menerima elektron dan tereduksi. Reaksi ini menghasilkan energi dalam bentuk panas dan cahaya.
Prinsip-Prinsip Dasar Reaksi Redoks
Untuk memahami reaksi redoks secara mendalam, mari kita pelajari prinsip-prinsip dasarnya:
1. Bilangan Oksidasi
Bilangan oksidasi adalah tingkat oksidasi suatu unsur dalam senyawa kimia. Bilangan oksidasi dinyatakan dengan angka bulat, baik positif maupun negatif. Penentuan bilangan oksidasi mengikuti aturan-aturan tertentu, antara lain:
- Bilangan oksidasi atom bebas adalah 0.
- Bilangan oksidasi ion monoatom sama dengan muatan ionnya.
- Dalam senyawa netral, jumlah bilangan oksidasi semua unsur adalah 0.
- Dalam ion poliatomik, jumlah bilangan oksidasi semua unsur sama dengan muatan ion tersebut.
Mengetahui bilangan oksidasi suatu unsur dalam senyawa sangat penting untuk mengidentifikasi reaksi oksidasi dan reduksi.
2. Oksidasi dan Reduksi
Oksidasi adalah proses hilangnya elektron oleh suatu zat, yang ditandai dengan kenaikan bilangan oksidasi. Sedangkan reduksi adalah proses penambahan elektron oleh suatu zat, yang ditandai dengan penurunan bilangan oksidasi.
Dalam reaksi redoks, oksidasi dan reduksi terjadi secara bersamaan. Zat yang teroksidasi (kehilangan elektron) disebut reduktor, sedangkan zat yang tereduksi (menerima elektron) disebut oksidator.
3. Setengah Reaksi
Untuk menganalisis reaksi redoks, kita dapat memecahnya menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi. Setengah reaksi oksidasi menggambarkan proses hilangnya elektron, sedangkan setengah reaksi reduksi menggambarkan proses penambahan elektron.
Dengan memisahkan reaksi menjadi dua setengah reaksi, kita dapat lebih mudah memahami dan menyeimbangkan reaksi redoks.
4. Bilangan Oksidasi dan Perubahan Bilangan Oksidasi
Perubahan bilangan oksidasi suatu unsur dalam reaksi redoks dapat digunakan untuk mengidentifikasi apakah suatu unsur mengalami oksidasi atau reduksi. Jika bilangan oksidasi suatu unsur meningkat, maka unsur tersebut mengalami oksidasi. Sebaliknya, jika bilangan oksidasi suatu unsur menurun, maka unsur tersebut mengalami reduksi.
Memahami perubahan bilangan oksidasi sangat penting dalam menyeimbangkan reaksi redoks dan menentukan oksidator serta reduktor dalam suatu reaksi.
Contoh Reaksi Redoks dalam Kehidupan Sehari-hari
Reaksi redoks tidak hanya terjadi di laboratorium kimia, tetapi juga dapat ditemukan dalam berbagai proses di kehidupan sehari-hari. Berikut beberapa contoh reaksi redoks yang sering kita temui:
Fotosintesis: Fotosintesis adalah proses di mana tumbuhan mengubah karbon dioksida (CO2) dan air (H2O) menjadi glukosa (C6H12O6) dengan bantuan energi cahaya matahari. Dalam proses ini, terjadi reaksi redoks di mana karbon dioksida (oksidator) tereduksi menjadi glukosa, sedangkan air (reduktor) teroksidasi menjadi oksigen.
Respirasi Sel: Respirasi sel adalah proses di mana sel-sel makhluk hidup mengubah glukosa menjadi energi dalam bentuk ATP. Dalam proses ini, glukosa (reduktor) teroksidasi menjadi karbon dioksida, sedangkan oksigen (oksidator) tereduksi menjadi air.
Pembakaran Bahan Bakar: Pembakaran bahan bakar, seperti bensin atau kayu, merupakan contoh reaksi redoks. Dalam proses pembakaran, bahan bakar (reduktor) teroksidasi dan bereaksi dengan oksigen (oksidator) untuk menghasilkan energi dalam bentuk panas dan cahaya.
Korosi Logam: Korosi logam adalah proses oksidasi logam oleh oksigen di udara atau air. Dalam proses ini, logam (reduktor) teroksidasi dan bereaksi dengan oksigen (oksidator) untuk membentuk senyawa oksida logam.
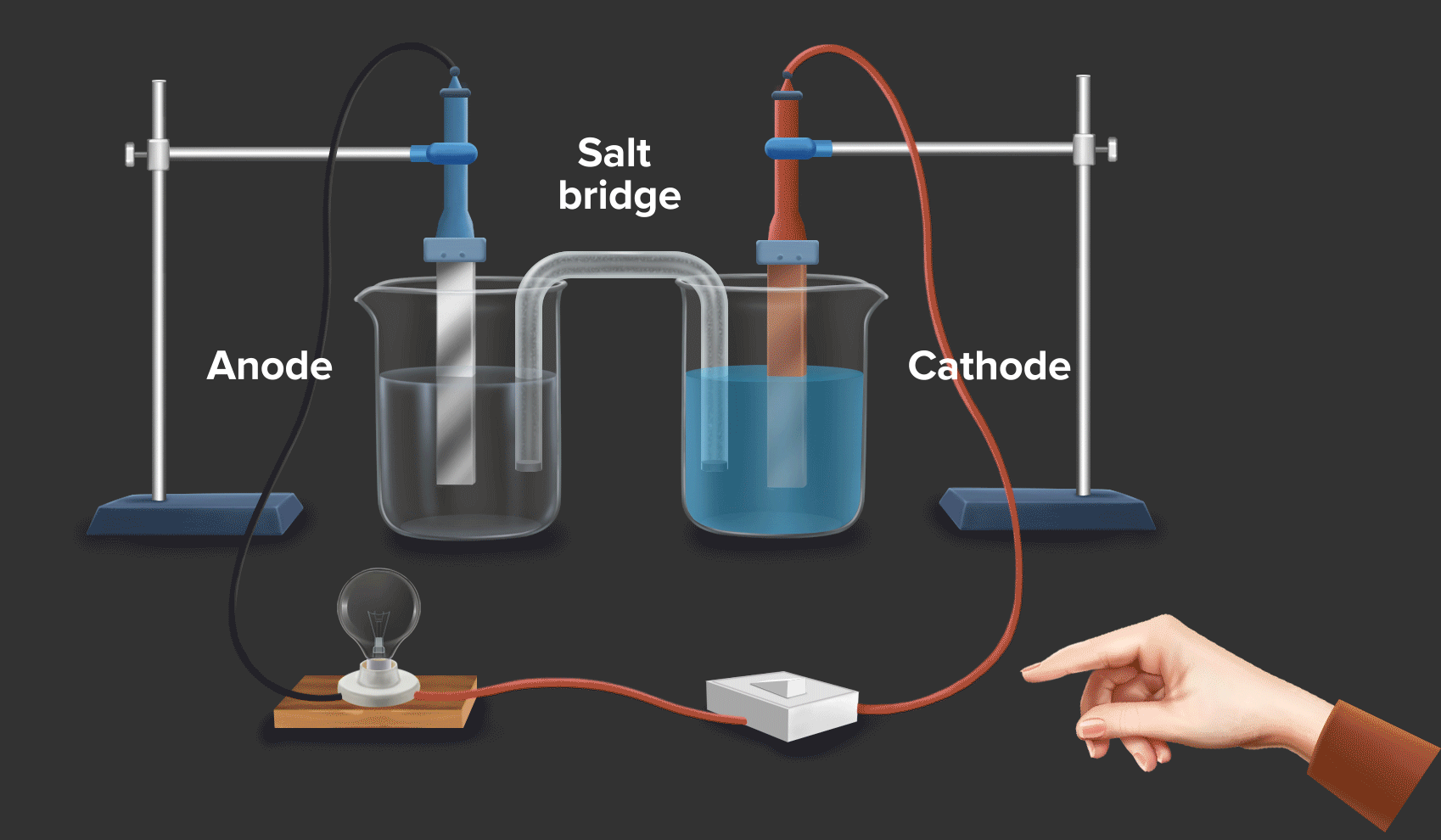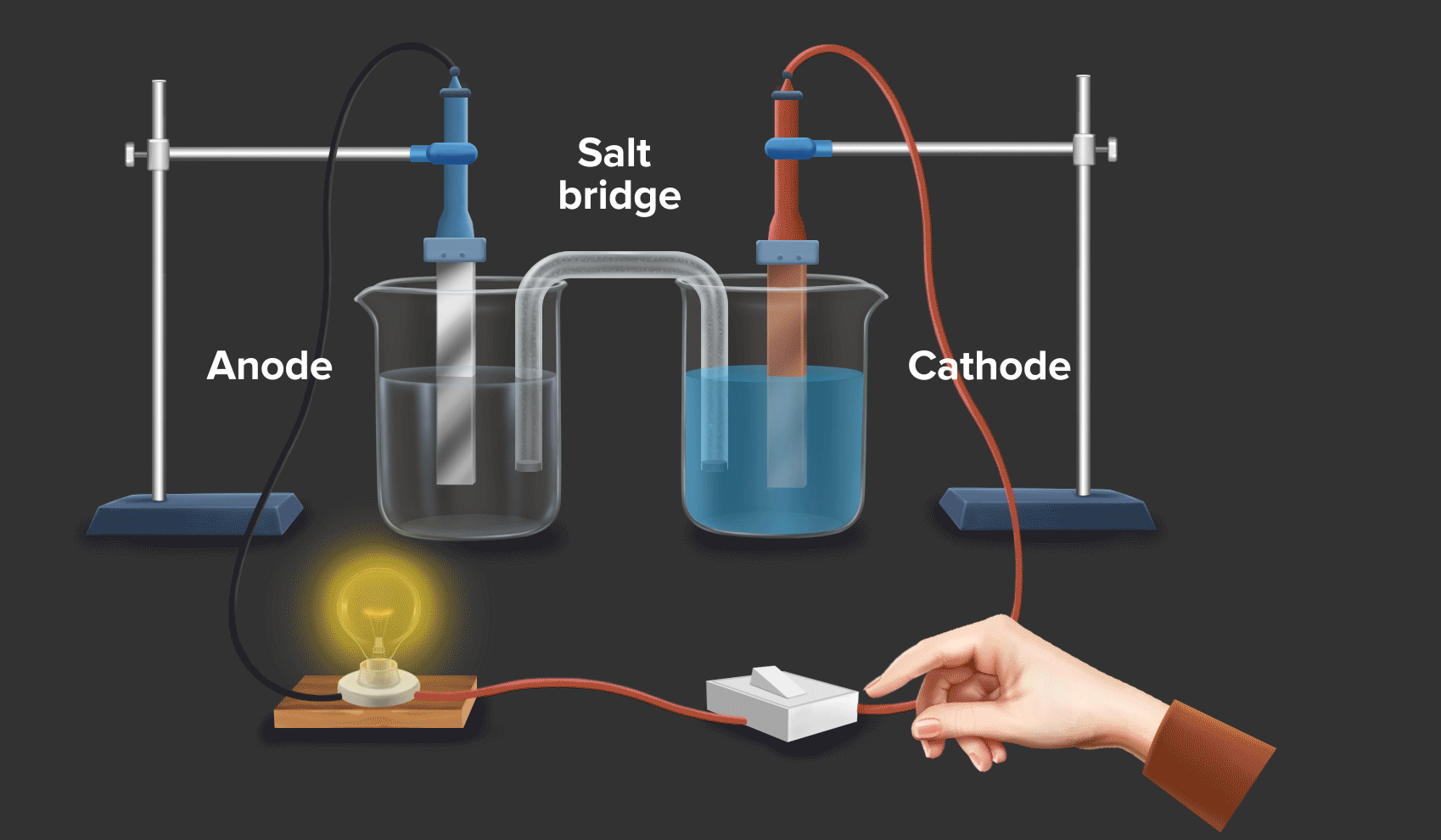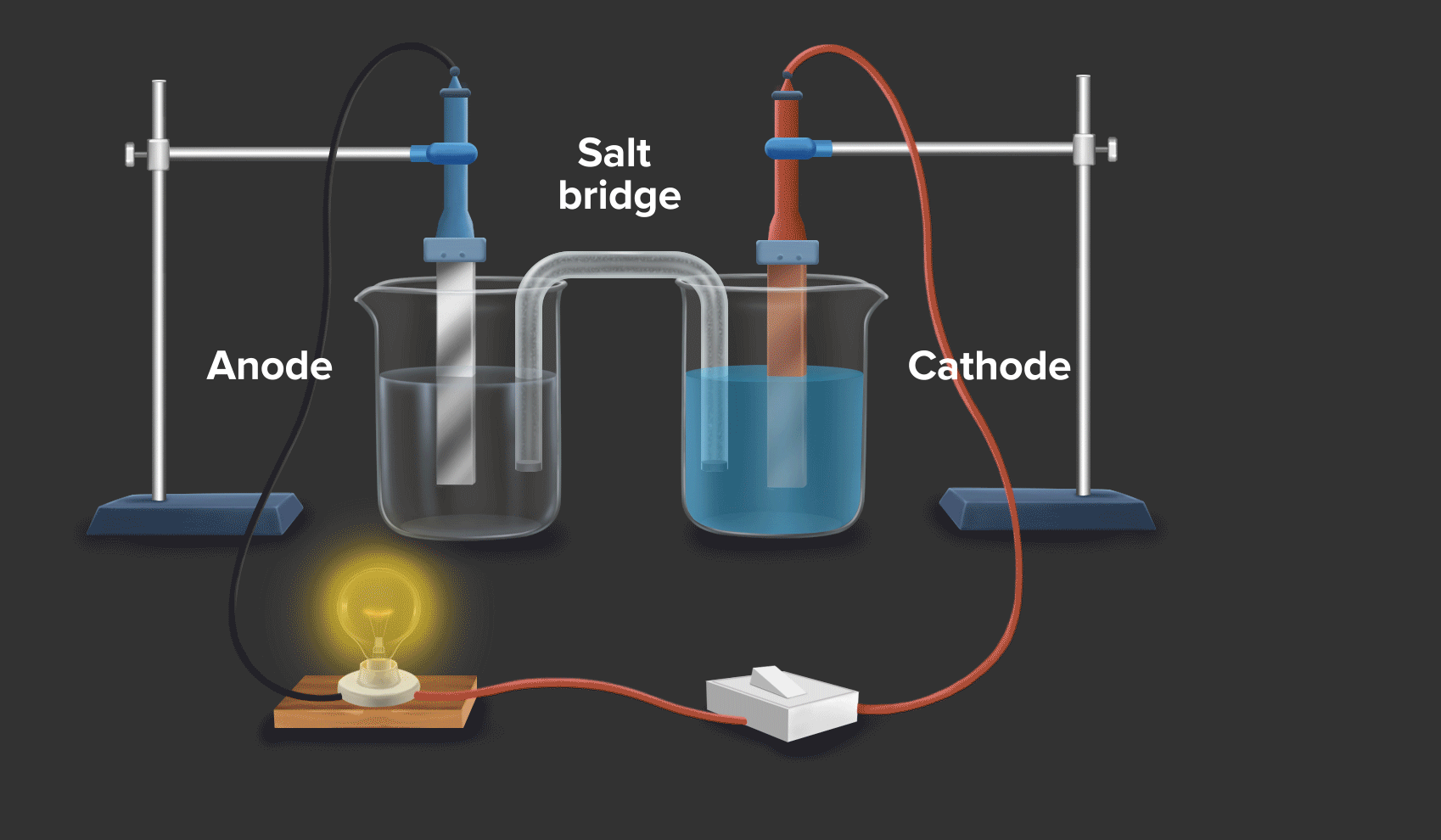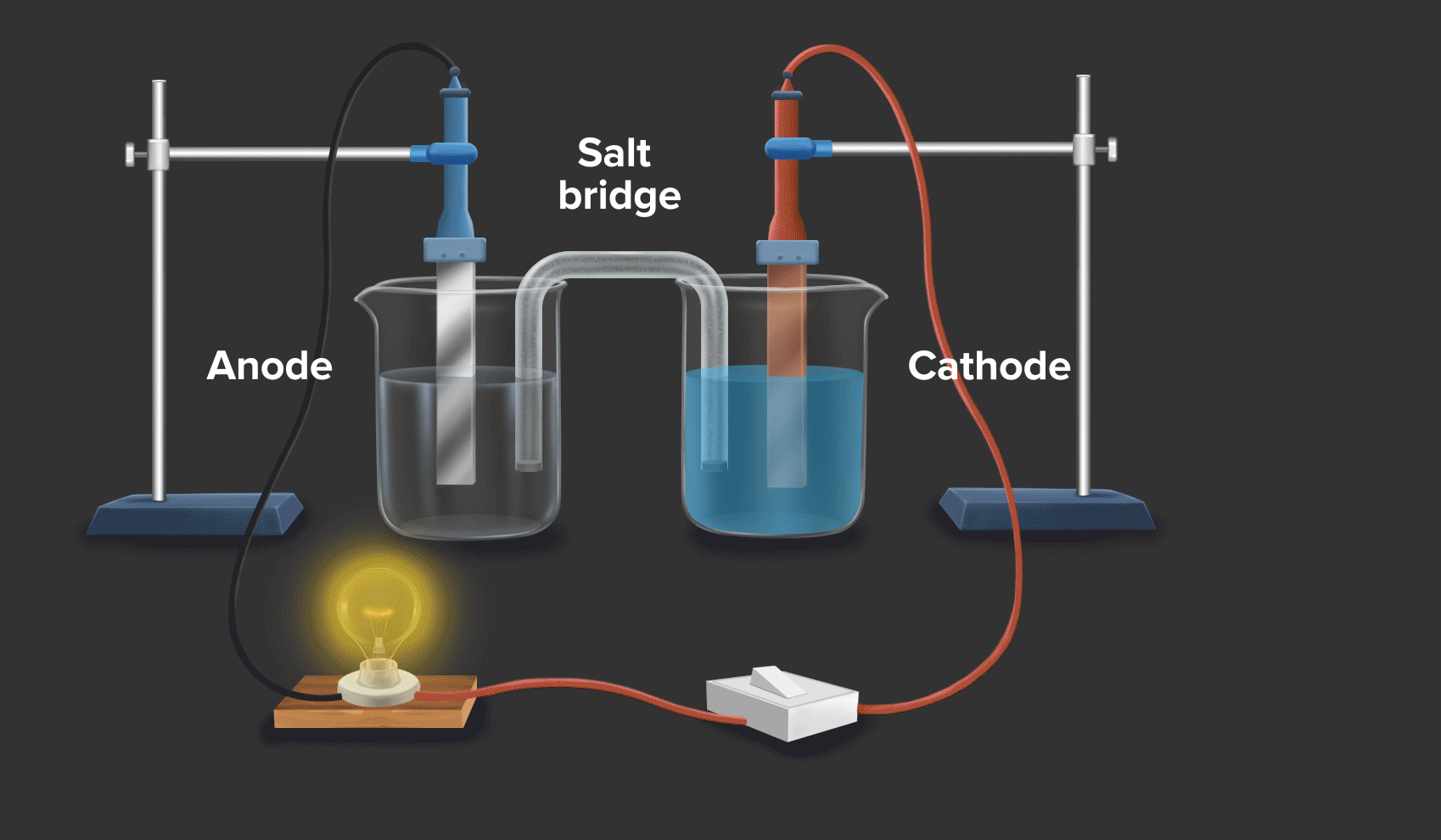
Baterai dan Sel Elektrokimia: Baterai dan sel elektrokimia lainnya memanfaatkan reaksi redoks untuk menghasilkan listrik. Dalam baterai, terjadi reaksi oksidasi dan reduksi di elektroda-elektroda yang menghasilkan aliran elektron dan arus listrik.
Contoh-contoh di atas menunjukkan bahwa reaksi redoks memainkan peran penting dalam berbagai proses alami dan teknologi yang kita jumpai sehari-hari. Memahami konsep reaksi redoks akan membantu kita memahami lebih dalam tentang fenomena-fenomena tersebut.
Menyeimbangkan Reaksi Redoks
Untuk menyeimbangkan reaksi redoks, kita perlu menentukan setengah reaksi oksidasi dan setengah reaksi reduksi, lalu menyatukan keduanya sehingga jumlah elektron yang hilang sama dengan jumlah elektron yang diterima.
Terdapat dua metode utama untuk menyeimbangkan reaksi redoks, yaitu:
Metode Setengah Reaksi: Dalam metode ini, kita memisahkan reaksi menjadi dua setengah reaksi, yaitu setengah reaksi oksidasi dan setengah reaksi reduksi. Kemudian, kita menyeimbangkan masing-masing setengah reaksi dengan menambahkan elektron, proton, dan molekul air (jika diperlukan). Setelah itu, kita menjumlahkan kedua setengah reaksi untuk mendapatkan reaksi redoks yang seimbang.
Metode Bilangan Oksidasi: Dalam metode ini, kita menentukan perubahan bilangan oksidasi pada setiap unsur dalam reaksi. Unsur yang mengalami kenaikan bilangan oksidasi adalah unsur yang teroksidasi, sedangkan unsur yang mengalami penurunan bilangan oksidasi adalah unsur yang tereduksi. Kemudian, kita menyeimbangkan reaksi dengan menyamakan jumlah elektron yang hilang dan yang diterima.
Kedua metode ini memiliki langkah-langkah yang berbeda, tetapi tujuannya sama, yaitu menyeimbangkan reaksi redoks dengan memperhatikan proses oksidasi dan reduksi yang terjadi.
Aplikasi Reaksi Redoks dalam Kehidupan
Reaksi redoks memiliki banyak aplikasi dalam berbagai bidang, antara lain:
Industri Kimia: Reaksi redoks digunakan dalam berbagai proses industri, seperti produksi bahan kimia, pengolahan logam, dan pemurnian senyawa. Contohnya, produksi amonia (NH3) melalui reaksi redoks antara nitrogen (N2) dan hidrogen (H2).
Energi dan Bahan Bakar: Reaksi redoks berperan penting dalam proses pembangkitan dan penyimpanan energi, seperti dalam baterai, sel bahan bakar, dan proses pembakaran bahan bakar.
Biologi dan Kesehatan: Reaksi redoks terlibat dalam proses-proses biologis, seperti fotosintesis, respirasi sel, dan proses oksidasi-reduksi dalam tubuh makhluk hidup. Selain itu, reaksi redoks juga dimanfaatkan dalam bidang kesehatan, misalnya dalam pengobatan dengan obat-obatan yang bekerja melalui mekanisme redoks.
Lingkungan: Reaksi redoks berperan dalam proses-proses alami di lingkungan, seperti siklus karbon, siklus nitrogen, dan proses pembentukan tanah. Pemahaman tentang reaksi redoks juga penting dalam upaya mengatasi masalah lingkungan, seperti pencemaran air dan tanah.
Teknologi Analitik: Reaksi redoks dimanfaatkan dalam berbagai teknik analisis kimia, seperti titrasi redoks, potensiometri, dan voltametri. Teknik-teknik ini digunakan untuk mengidentifikasi dan mengukur konsentrasi zat-zat kimia dalam sampel.
Dengan memahami konsep reaksi redoks secara mendalam, kita dapat menerapkannya dalam berbagai bidang kehidupan, mulai dari industri, energi, kesehatan, lingkungan, hingga teknologi analitik. Penguasaan reaksi redoks menjadi kunci untuk memahami dan menyelesaikan berbagai permasalahan di berbagai disiplin ilmu.
Kesimpulan
Reaksi redoks, atau reaksi oksidasi-reduksi, merupakan salah satu konsep fundamental dalam kimia yang memainkan peran penting dalam berbagai proses, baik di alam maupun dalam kehidupan sehari-hari. Memahami definisi, prinsip-prinsip dasar, dan aplikasi reaksi redoks akan memberikan pemahaman yang kuat dalam bidang kimia dan membantu kita menjelaskan serta memecahkan berbagai permasalahan yang berkaitan dengan reaksi redoks.
Dengan mempelajari reaksi redoks secara mendalam, Anda akan memiliki kemampuan untuk:
- Menentukan bilangan oksidasi suatu unsur dalam senyawa kimia.
- Mengidentifikasi proses oksidasi dan reduksi dalam suatu reaksi.
- Menyeimbangkan reaksi redoks menggunakan metode setengah reaksi atau metode bilangan oksidasi.
- Memahami dan menjelaskan berbagai aplikasi reaksi redoks dalam industri, energi, biologi, lingkungan, dan teknologi analitik.
Penguasaan konsep reaksi redoks akan memberikan Anda pemahaman yang lebih komprehensif tentang kimia dan memungkinkan Anda untuk menerapkannya dalam berbagai situasi praktis. Teruslah belajar, berlatih, dan mengeksplorasi reaksi redoks untuk menjadi semakin mahir dalam bidang ini.