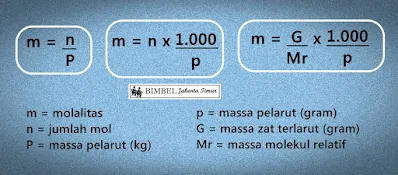
Kemolalan atau molalitas adalah jumlah mol zat terlarut dalam 1 (satu) kg pelarut. Fraksi mol adalah perbandingan jumlah mol zat terlarut atau pelarut dengan jumlah mol larutan. Kemolalan dan fraksi mol merupakan sifat koligatif larutan, yaitu sifat larutan yang tidak bergantung pada jenis zat terlarut melainkan hanya pada konsentrasi partikel terlarutnya.
Berikut adalah soal-soal untuk membantumu memahami perhitungan sifat-sifat tersebut.
1. MgSO40,1 mol yang dilarutkan dalam 400 mL air akan menghasilkan larutan magnesiumsulfat dengan kemolalan ……
Massa jenis air=1 g/mL
Massa jenis air=1 g/mL
A. 0,1 B. 0,25 C. 0,5 D. 1 E. 1,2
Pembahasan :
Diketahui : n MgSO4 =0,1 mol
V air =400 mL
⍴ air =1 g/mL
Ditanya : m ?
Jawab : pelarut (p)=⍴ x V
=1 x 400
=400 gram
Pembahasan :
Diketahui : n MgSO4 =0,1 mol
V air =400 mL
⍴ air =1 g/mL
Ditanya : m ?
Jawab : pelarut (p)=⍴ x V
=1 x 400
=400 gram
m=0,1 x 1.000
400
=0,1 x 2,5
=0,25 molal (B)
400
=0,1 x 2,5
=0,25 molal (B)
2. Larutan 1molal NaOH terbuat dari 20 gram NaOH dengan air sebanyak…..
(Ar Na=23,O=16 dan H=1)
A. 200 gram D. 500 gram
A. 200 gram D. 500 gram
B. 250gram E. 1 kg
C. 400 gram
Pembahasan :
Diketahui : m NaOH =1 molal
G NaOH=20 gram
Mr =23 + 16 + 1=40
Ditanya : p ?
Jawab : m= G x 1.000
Mr p
1= 20 x 1.000
40 p
Pembahasan :
Diketahui : m NaOH =1 molal
G NaOH=20 gram
Mr =23 + 16 + 1=40
Ditanya : p ?
Jawab : m= G x 1.000
Mr p
1= 20 x 1.000
40 p
1= 500
p
p=500 gram (D)
p
p=500 gram (D)
3. Kemolalanlarutan 15 gram urea CO(NH2)2 dalam 200 mL air adalah….
(Ar N=14,H=1, C=12, O=16 dan massa jenis air=1 g/mL)
A.0,125 B. 0,250 C. 0,500
D. 1,000 E. 1,250
Pembahasan :
Diketahui : G urea =15 gram
Mr =12 + 16 + 2 (14 + 2)=60
V air =200 mL
⍴ air =1 g/mL
Ditanya : m ?
Jawab : pelarut (p)=⍴ x V
=1 x 00
=200 gram
m= G x 1.000
Mr p
m=15 x 1.000
60 200
=1,25 molal (E)
Pembahasan :
Diketahui : G urea =15 gram
Mr =12 + 16 + 2 (14 + 2)=60
V air =200 mL
⍴ air =1 g/mL
Ditanya : m ?
Jawab : pelarut (p)=⍴ x V
=1 x 00
=200 gram
m= G x 1.000
Mr p
m=15 x 1.000
60 200
=1,25 molal (E)
4. Berapamassa glikol (C2H6O2) yang harus dicampurkanke dalam 100 gram air untuk menghasilkan larutan dengan kemolalan 5?
A. 16gram D. 62 gram
B. 31gram E. 90 gram
C. 55 gram
Pembahasan :
Diketahui : Mr =24 + 6 + 32=62
p =100 gram
m =5 molal
Ditanya : G ?
Jawab : m= G x 1.000
Mr p
5= G x 1.000
62 100
G=5 x 62 x 100
1.000
=31 gram (B)
Pembahasan :
Diketahui : Mr =24 + 6 + 32=62
p =100 gram
m =5 molal
Ditanya : G ?
Jawab : m= G x 1.000
Mr p
5= G x 1.000
62 100
G=5 x 62 x 100
1.000
=31 gram (B)
5. Kemolalandari larutan glukosa 36 % ?
A.3,125 B. 3,750 C. 4,000
D. 5,25 D. 6,25
Pembahasan :
Diketahui : Kadar glukosa dalam air=36 %,
Mr glukosa=180
Mr air=18
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 36 x 1.000
180 64
m= 3,750 molal (B)
Pembahasan :
Diketahui : Kadar glukosa dalam air=36 %,
Mr glukosa=180
Mr air=18
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 36 x 1.000
180 64
m= 3,750 molal (B)
6. Suatularutan cuka (CH3COOH) mempunyai kemolalan 4,1. Berapa kadar cukadalam larutan tersebut?
A. 15% B. 18% C. 20% D. 24% E. 25%
Pembahasan :
Diketahui : Mr =60
m=4,1 molal
Ditanya : % cuka ?
Jawab : m= G x 1.000
Mr p
4,1= G x 1.000
60 p
G = 4,1 x 60
p 1.000
Pembahasan :
Diketahui : Mr =60
m=4,1 molal
Ditanya : % cuka ?
Jawab : m= G x 1.000
Mr p
4,1= G x 1.000
60 p
G = 4,1 x 60
p 1.000
G = 246
p 1.000
kadar cuka=_ G _ x 100%
G + p
= 246 x 100%
1.246
=19,7 % ⋍ 20 % (C)
p 1.000
kadar cuka=_ G _ x 100%
G + p
= 246 x 100%
1.246
=19,7 % ⋍ 20 % (C)
7. Kadarglukosa dalam larutan glukosa 1 molal adalah….. (Mr glukosa=180)
A. 15% B.18% C. 20% D. 24% E. 25%
Pembahasan :
Diketahui : Mr =180
m =1 molal
Ditanya : % glukosa ?
Jawab : m= G x 1.000
Mr p
1= G x 1.000
180 p
G = 1 x 180
p 1.000
Diketahui : Mr =180
m =1 molal
Ditanya : % glukosa ?
Jawab : m= G x 1.000
Mr p
1= G x 1.000
180 p
G = 1 x 180
p 1.000
G = 18
p 100
kadar glukosa= _ G _ x 100%
G + p
= 18 x 100%
118
=15,2 % ⋍ 15 % (A)
p 100
kadar glukosa= _ G _ x 100%
G + p
= 18 x 100%
118
=15,2 % ⋍ 15 % (A)
8. Kemolalanlarutan yang dibuat dengan melarutkan 9 gramurea (Mr=60) dalam 100 gram air adalah … mol/kg
A. 0,015 B.0,15 C. 1,5 D. 15 E. 16
Pembahasan :
Diketahui : G =9 gram
Mr=60
p =100 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 9 x 1.000
60 100
=1,5 (C)
A. 0,015 B.0,15 C. 1,5 D. 15 E. 16
Pembahasan :
Diketahui : G =9 gram
Mr=60
p =100 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 9 x 1.000
60 100
=1,5 (C)
9. Massa sukrosa (C12H22O11)yang harus dilarutkan dalam 50 ml air agar terbentuk 1 molal larutan sukrosaadalah… gram
A. 1,71 B. 3,42 C. 17,1
D. 34,2 E. 171
Pembahasan :
Diketahui : Mr=342
p =50 gram ( ingat ⍴ air=1 g/mL)
m=1
Ditanya : G ?
Jawab : m= G x 1.000
Mr p
1= G x 1.000
342 50
G =342 x 50
1.000
Pembahasan :
Diketahui : Mr=342
p =50 gram ( ingat ⍴ air=1 g/mL)
m=1
Ditanya : G ?
Jawab : m= G x 1.000
Mr p
1= G x 1.000
342 50
G =342 x 50
1.000
=17,1 gram (C)
10. Volumeair yang dibutuhkan untuk melarutkan 23,4 gram NaCl dapat menjadi larutan NaCl2 molal adalah…. mL
A. 50 B. 100 C. 150 D. 200 E. 250
Pembahasan :
Diketahui : G =23,4 gram
Mr=58,5
m=2
Ditanya : V ?
Jawab : m= G x 1.000
Mr p
2= 23,4 x 1.000
58,5 p
p=23,4 x 1.000
58,5 x 2
=200 gram
V=200 mL (D)
Pembahasan :
Diketahui : G =23,4 gram
Mr=58,5
m=2
Ditanya : V ?
Jawab : m= G x 1.000
Mr p
2= 23,4 x 1.000
58,5 p
p=23,4 x 1.000
58,5 x 2
=200 gram
V=200 mL (D)
11. Sebanyak2,1 gram soda kue (NaHCO3) dilarutkan dengan 250 ml air. Makamolalitas larutan yang dihasilkan adalah….
A. 0,1 B. 0,2 C. 0,4 D. 1 E. 2
Pembahasan :
Diketahui : G =2,1 gram
Mr=84
p=250 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 2,1 x 1.000
84 250
=0,1 (A)
Pembahasan :
Diketahui : G =2,1 gram
Mr=84
p=250 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 2,1 x 1.000
84 250
=0,1 (A)
12.Molalitas larutan yang mengandung 4,9 gram H2SO4 dalam100 ml air adalah….
A. 0,05 B. 0,1 C. 0,2 D. 0,4 E. 0,5
Pembahasan :
Diketahui : G =4,9 gram
Mr=98
p=100 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 4,9 x 1.000
98 100
=0,5 (E)
Pembahasan :
Diketahui : G =4,9 gram
Mr=98
p=100 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= 4,9 x 1.000
98 100
=0,5 (E)
13. Larutanyang dibuat dari 6 gram urea dalam 200 mL air yang dicampur dengan 12 gram ureadalam 300 mL air akan membentuk larutan urea dengan kemolalan …
A. 1,1 B. 1,0 C. 0,8 D. 0,6 E. 0,3
Pembahasan :
Diketahui : G1 =6 gram
Mr=60
p1=200 gram
G2 =12 gram
p2 =300 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= (6+12) x 1.000
60 (200+300)
= 18 x 1.000
60 500
=0,6 (C)
Pembahasan :
Diketahui : G1 =6 gram
Mr=60
p1=200 gram
G2 =12 gram
p2 =300 gram
Ditanya : m ?
Jawab : m= G x 1.000
Mr p
m= (6+12) x 1.000
60 (200+300)
= 18 x 1.000
60 500
=0,6 (C)
14.Fraksimol urea dalam suatu larutan yang mengandung 24 gram urea CO(NH2)2 dan108 gram air adalah…
A. ½ B. ⅓ C. ¼ D. ¹/₈ E.¹/₁₆
Pembahasan :
Diketahui : G=24 gram
Mr urea=60
p=108 gram
Mr air=18
Ditanya : Xt ?
nt = 24 =0,4
60
np =108 =6
18
Jawab :
Xt = 0,4
0,4 + 6
= 0,4
6,4
=¹/₁₆ (E)
Pembahasan :
Diketahui : G=24 gram
Mr urea=60
p=108 gram
Mr air=18
Ditanya : Xt ?
nt = 24 =0,4
60
np =108 =6
18
Jawab :
Xt = 0,4
0,4 + 6
= 0,4
6,4
=¹/₁₆ (E)
15. Glukosa C6H12O6sebanyak 30 gram dilarutkan dengan 52 gram benzena (C6H6).Fraksi mol glukosa adalah…
A. 0,05 B. 0,1 C. 0,2 D. 0,4 E. 0,5
Pembahasan :
Diketahui : G=30 gram
Mr glukosa=180
p=52 gram
Mr benzena=78
Ditanya : Xt ?
nt = 30 = 1
180 6
np = 52 = 4
78 6
Jawab :
Pembahasan :
Diketahui : G=30 gram
Mr glukosa=180
p=52 gram
Mr benzena=78
Ditanya : Xt ?
nt = 30 = 1
180 6
np = 52 = 4
78 6
Jawab :
16. 30 gramCaCO3 dilarutkan dengan 30 gram asam asetat (CH3COOH).Fraksi mol kalsium karbonat adalah….
A. 0,125 B. 0,375 C. 0,45
D. 0,5 E. 0,625
Pembahasan:
Diketahui: G=30 gram
Mr CaCO3=100
p=30 gram
Mr (CH3COOH)=60
Ditanya : Xt ?
n t = 30 = 0,3
100
np = 30 = 0,5
60
Jawab :
Diketahui: G=30 gram
Mr CaCO3=100
p=30 gram
Mr (CH3COOH)=60
Ditanya : Xt ?
n t = 30 = 0,3
100
np = 30 = 0,5
60
Jawab :
Xt = 0,3
0,3 + 0,5
= 0,3
=0,375 (B)
17. Larutanurea dalam air kadarnya 10%. Fraksi mol air dalam larutan tersebut adalah….
A. 1/30 B. 1/31 C. 3/31 D. 30/31 E. 31/30
Pembahasan:
18.Fraksi mol HCl dari larutan 37% asam klorida adalah….
(Ar H=1, Cl=35,5 danO=16)
Pembahasan:
Diketahui: Kadar urea dalam air=10 %,
maka dianggap G=10 dan p=100-10=90
Mr urea=60
Mr air=18
Ditanya : Xt ?
nt = 10 = 1
60 6
Mr urea=60
Mr air=18
Ditanya : Xt ?
nt = 10 = 1
60 6
np = 90 = 30
18 6
Jawab :
18 6
Jawab :
Xt = 1/6
1/6 + 30/6
= 1/6
31/6
=1/31 (C)
18.Fraksi mol HCl dari larutan 37% asam klorida adalah….
(Ar H=1, Cl=35,5 danO=16)
A. 1/7 B. 2/7 C. 1/9 D. 2/9 E. 7/9
Pembahasan:
Pembahasan:
Diketahui: Kadar HCl dalam air=37 %,
maka dianggap G=37 dan p=100-37=63
Mr HCl=36,5
Mr air =18
Ditanya : Xt ?
nt = 37 ⋍ 1
36,5
Mr HCl=36,5
Mr air =18
Ditanya : Xt ?
nt = 37 ⋍ 1
36,5
np =63 =3,5
18
Jawab :
18
Jawab :
Xt = 1
1 + 3,5
= 1
4,5
=2/9 (D)19. Larutannatrium hidroksida dibuat dari 12 gram NaOH yang dilarutkan dengan 27 gram air.Fraksi mol NaOH dalam larutan adalah….
A. 1/3 B. 1/5 C. 1/6 D. 2/5 E. 5/6
A.4 gram B. 8 gram C. 10 gram
D.20 gram E. 25 gram
11 nt + 5
G =0,5
40
G =0,5 x 40=20 gram (D)
Pembahasan
Diketahui: Xt =1/11
Mr NaOH =40
p=90 gram
Mr air =18
Ditanya : G?
n t = G
40
np = 90 =5
18
Jawab :
Diketahui: Xt =1/11
Mr NaOH =40
p=90 gram
Mr air =18
Ditanya : G?
n t = G
40
np = 90 =5
18
Jawab :
Xt= nt
nt + np
1 = nt 11 nt + 5
nt + 5 =11 nt
5 =11nt - nt
5 =10 nt
nt =0,55 =11nt - nt
5 =10 nt
G =0,5
40
G =0,5 x 40=20 gram (D)
21. Fraksimol air dalam larutan 20 gram urea dan 24 gram air adalah….
A. 0,2 B. 0,4 C. 0,6 D. 0,8 E. 1,0
Pembahasan
Diketahui: G=20 gram
Mr urea=60
p=24 gram
Mr air =18
Ditanya : Xt ?
n t = 20 = 1
60 3
np = 24 = 4
18 3
Jawab :
Diketahui: G=20 gram
Mr urea=60
p=24 gram
Mr air =18
Ditanya : Xt ?
n t = 20 = 1
60 3
np = 24 = 4
18 3
Jawab :
Xt = 1/3
1/3 + 4/3
= 1/3
=0,2 (A)
22. Fraksimol etanol (C2H5OH) dalam larutan 46 % etanol adalah…
A. 0,1 B. 0,2 C. 0,25 D. 0,3 E. 0,4
Pembahasan:
=0,25 (D)
Pembahasan:
Diketahui: Kadar etanol dalam air=46 %,
maka dianggap G=46 dan p=100-46=54
Mr etanol=46
Mr air =18
Ditanya : Xt ?
nt = 46 =1
46
Mr etanol=46
Mr air =18
Ditanya : Xt ?
nt = 46 =1
46
np = 54 =3
18
Jawab :
18
Jawab :
Xt = 1
1 + 3
= 1
4
=0,25 (D)
23. Fraksimol natrium klorida dalam larutan NaCl adalah 0,17. Fraksi mol air dalamlarutan tersebut adalah….
A. 0,18 B. 0,23 C. 0,71 D. 0,83 E. 0,93
Pembahasan :
Diketahui : Xt =0,17
Ditanya Xp ?
Jawab :
Xt + Xp =1
0,17 + Xp =1
Xp =1 - 0.17
=0,83 (D)
Pembahasan :
Diketahui : Xt =0,17
Ditanya Xp ?
Jawab :
Xt + Xp =1
0,17 + Xp =1
Xp =1 - 0.17
=0,83 (D)
24. Suatularutan terdiri dari 5 mol zat A, 6 mol zat B dan 9 mol zat C. Pernyataan yangbenar adalah….
A. XA=5, XB =6 dan xC=9
B. XA=0,5, XB =0,6 dan xC=0,9
C. XA=0,2, XB =0,3 dan xC=0,4
D. XA=0,25, XB =0,3 dan xC=0,45
E. XA=0,25, XB =0,3 dan xC=0,4
Pembahasan :
Diketahui : nA =5
nB =6
nC =9
Ditanya : XA, XB, XC ?
Jawab :
XA = XA
Pembahasan :
Diketahui : nA =5
nB =6
nC =9
Ditanya : XA, XB, XC ?
Jawab :
XA = XA
XA + XB + XC
= 5
5 + 6 + 9
= 5
20
=0,25
= 5
5 + 6 + 9
= 5
20
=0,25
XB = XB
XA + XB + XC
= 6
5 + 6 + 9
= 6
20
=0,3
= 6
5 + 6 + 9
= 6
20
=0,3
XC = XC
XA + XB + XC
= 9
5 + 6 + 9
= 9
20
=0,45 (D)
= 9
5 + 6 + 9
= 9
20
=0,45 (D)
25. Sebanyak 46 gram gliserol (Mr=92) dicampur dengan 27gram air . Pernyataan yang benar adalah….
A. Xt =2 dan xp=3
B. Xt =0,2 dan xp=0,3
C. Xt =0,2 dan xp=0,8
D. Xt =0,25 dan xp=0,8
E. Xt =0,25 dan xp=0,75
Demikian soal-soal latihan yang dapat kami sajikan. Semoga soal-soal latihan ini dapat membantumu untuk lebih memahami materi molalitas dan fraksi mol.
Kepada sesama penulis mohon untuk tidak menyalin dan mempublikasikan sebagian atau seluruh isi artikel ini tanpa izin.
Jika ada pertanyaan tentang isi artikel silahkan komentar pada artikel yang dimaksud, bukan pada nomer whatsapp yang kami cantumkan. Nomer ini adalah untuk keperluan pendaftaran dan informasi bimbel, bukan jasa tanya jawab soal.