Hukum-hukum Dasar Kimia
1. Hukum kekekalan massa (hukum Lavoisier) : massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat setelah reaksi.
contoh : 3 gram gas hidrogen(H2) yang bereaksi dengan 24 gram gas oksigen (O2) akan membentuk 27 gram air (H2O)
2. Hukum perbandingan tetap (hukum Proust) : perbandingan massa unsur dalam senyawa selalu tetap.
contoh :
H2 | O2 | H2O | Keterangan |
1 gram | 8 gram | 9 gram | |
2 gram | 8 gram | 9 gram | sisa H2=1 gram |
2 gram | 17 gram | 18 gram | sisa O2=1 gram |
4 gram | 25 gram | 27 gram | sisa H2=1 gram, O2=1 gram |
3. Hukum perbandingan berganda ( hukum Dalton) : jika dua unsur dapat membentuk lebih dari satu senyawa dan massa salah satu unsur tersebut tetap(sama), perbandingan massa unsur yang lain dalam senyawa tersebut merupakan bilangan bulat sederhana.
contoh :
Perbandingan H : O dalam H2O =2 : 16=1 : 8
Perbandingan H : O dalam H2O2=2 : 32=1 : 16
Dalam hidrogen yang sama massanya dapat bersenyawa dengan oksigen yang massanya berbanding sebagai 8 :16 atau 1 : 2
4. Hukum perbandingan volume (hukum Gay –Lussac) : volume gas-gas yang bereaksi dan gas-gas hasil reaksi jika diukur pada suhu dan tekanan yang sama berbanding sebagai bilangan bulat dan sederhana.
contoh :
Gas pentana C5H12 yang mempunyai volume 2 liter dibakar sempurna menurut reaksi :
C5H12 + 8 O2 ⇒ 5 CO2 + 6 H2O
Tentukan volume gas oksigenyang dibutuhkan dan volume gas karbondioksida serta uap air yang terbentuk!
Jawab :
Perbandingan koefisien C5H12 : O2 :CO2 : H2O=1 : 8: 5 : 6, maka
Volume O2 yangdibutuhkan=8/1 x 2 liter=16 liter
Volume CO2 yang terbentuk=5/1 x 2 liter=10 liter
Volume H2O yang terbentuk=6/1 x 2 liter=12 liter
5. Hipotesis Avogadro : pada suhu dan tekanan yang sama, semua gas yang memiliki volume sama akan mengandung jumlah molekul yang sama.
contoh:
Jika diketahui uap air bervolume 250 ml, tentukanlah jumlah mol uap air tersebut pada keadaan dimana gas karbon dioksida bermassa 2,2 gram mempunyai volume 500 ml.
Jawab :
6. HukumBoyle – Gay Lussac : hasil kali tekanan gas dan volume gas akan selalu tetap jika dibagi suhu mutlak.
Massa Atom Relatif dan Massa MolekulRelatif
1. Massa atom dapat ditentukan dengan alat spectrometer massa. Hasil pembacaan spectrometer massa disebut spektrografmassa.
2. Satu satuanmassa atom (1 sma) : massa suatu partikel yang nilainya sebesar 1,67 x 10-7kg.
3. Massa satu atom C-12 adalah 12 sma.
4. Massa atom relatif (Ar) adalah massa rata-ratasuatu atom relative (dibandingkan) dengan 1/12 kali massa atom C-12.
 |
| rumus 1 |
5. Massa atom relatif dari isotop-isotop di alam. Di alam, suatu unsur bisa didapatkan dalam dua jenis atau bahkan lebih isotop. Rumus menentukan atom relatifnya adalah :
 |
| rumus 2 |
6. Massa molekul relatif (Mr) merupakan jumlah massa atom relatif dari seluruh atom penyusun suatu molekul.
Persamaan Reaksi
1. Persamaan reaksi : cara memberikan lambang bagi suatu perubahan kimia (reaksi kimia). Persamaan reaksi menggambarkan rumus kimia zat-zat pereaksi dan zat-zat hasil reaksi.
2. Zat Perekasi (reaktan) :zat-zat yang mengalami perubahan dalam reaksi kimia.
3. Zat hasil reaksi (produk) :zat-zat hasil perubahan dalam reaksi kimia.
Perhitungan Kimia
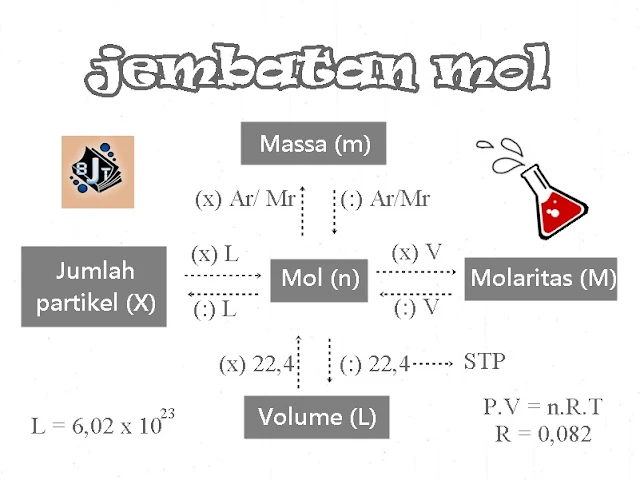 |
| Jembatan mol |
1. Satu mol suatu zat : sejumlah partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan 6,02 x 1023 partikel.
2. Tetapan Avogadro (L) : bilangan yang digunakan untuk menyatakan jumlah partikel satu mol zat yaitu 6,02 x 1023 partikel.
3. Massa molar : massa yang dimiliki oleh 1mol zat yang sama dengan massa atom relative atau massa rumus relatif zat tersebut dan dinyatakan dalam gram per mol.
4. Volume molar gas menyatakan volume yang ditempati satu mol gas pada suhu dan tekanan tertentu. Volume molar gas tidak tergantung pada jenisnya, tetapi pada jumlah mol, suhu dan tekanan pengukuran.
5. Standard Temperature Pressure (STP) : keadaan gas pada suhu 0oC dan tekanan 1 atmosfer. Pada STP, volume molar gas sama dengan 22,4 L/mol.
6. Room Temperature Pressure (RTP) : keadaangas pada suhu 25oC dan tekanan 1 atmosfer. Pada RTP, volume molar gas sama dengan 24,4 L/mol.
7. Kemolaran zat menyatakan jumlah mol zat terlarut dalam tiap liter larutan.
8. Pereaksi pembatas : pereaksi yang habis bereaksi terlebih dahulu dalam suatu reaksi kimia.
9. Rumus empiris : perbandingan paling sederhana dalam komposisi suatu senyawa.
Rumus molekul adalah kelipatan dari rumus empiris.
10. Hidrat : zat padat yang mengikat beberapamolekul air sebagai bagian dari struktur kristalnya.
contoh : CuSO4.5H2O,FeSO4.7H2O dan lain sebagainya.
Langkah-langkah Penyelesaian Perhitungan Kimia
1. Menuliskan persamaan reaksi lengkap dengan koefisien yang tepat.
2. Menghitung mol zat dari data yang diketahui dengan rumus yang sesuai.
3. Menentukan pereaksi pembatas berdasarkan perbandingan koefisien reaksi
4. Menentukan mol zat yang ditanyakan berdasarkan pada perbandingan koefisien reaksi.
5. Jawab pertanyaan dengan menggunakan molzat yang telah dicari pada tahap di atas.
contoh :
Sejumlah 3,2 gramgas metana (CH4) dibakar dengan 16 gram gas oksigen. Berapa massa gas karbon dioksida yang terbentuk?
jawab :
1. Persamaan reaksi
CH4 + 2 O2 ⇒ CO2 + 2 H2O
2. Mol zat yang diketahui
nCH4=massa/Mr =3,2/(12+4) =0,2 mol
nO2= massa/Mr = 16/(2.16) =0,5 mol
3. Perbandingan koefisien dari persamaan reaksi (no.1)
CH4: O2 : CO2 : H2O=1 : 2 : 1 : 2
CH4=0,2 mol/1 =0,2 mol
O2= 0,5 mol/2=0,25 mol
hasil pembagian CH4 lebih kecil dari O2 , maka CH4 adalah pereaksi pembatas
4. Mol zat yang ditanyakan
nCO2=1/1 x 0,2 mol=0,2 mol
5. Jawab pertanyaan
massaCO2=n x Mr
=0,2 mol x (12+2(16))
=0,2 x 44
=8,8 gram




