Dalam Hidrokarbon Bimbel Jakarta Timur akan membahas secara tuntas dan jelas mengenai hidrokarbon dan yang berhubungan dengan hidrokarbon Senyawa hidrokarbon terdiri dari atom karbon (C) dan atom hidrogen (H). Atom C dan H dalam senyawa dapat ditunjukkan dengan uji pembakaran. Pada pembakaran sempurna, atom C akan menjadi CO2 sedangkan atom H akan menjadi H2O.
Atom karbon mempunyai 4 elektron valensi sehingga atom C dapat membentuk empat ikatan kovalen untuk mencapai konfigurasi oktet. Atom karbon juga memiliki kemampuan membentuk rantai. Rantai karbon dapat berbentuk lurus, bercabang ataupun melingkar.
Berdasarkan bentuk rantainya, senyawa karbon dapat dibagi menjadi senyawa alifatik, senyawa siklik dan senyawa aromatik.
Senyawa Alifatik : Senyawa hidrokarbon dengan rantai terbuka jenuh (ikatan tunggal) maupun tidak jenuh (ikatan rangkap).
Senyawa Siklik : Senyawa hidrokarbon yang rantai karbonnya tertutup atau melingkar.
Senyawa Aromatik : Senyawa hidrokarbon siklik yang mempunyai ikatan-ikatan karbon tunggal dan rangkap selang seling.
Senyawa hidrokarbon alifatik terdiri dari alkana, alkena dan alkuna.
ALKANA
Alkana adalah senyawa hidrokarbon alifatik jenuh yaitu ikatan pada rantainya adalah ikatan tunggal. Alkana memiliki rumus umum CnH2n+2
Jumlah atom C Rumus Molekul Nama Alkana
- CH4 metana
- C2H6 etana
- C3H8 propana
- C4H10 butana
- C5H12 pentana
- C6H14 heksana
- C7H16 heptana
- C8H18 oktana
- C9H20 nonana
- C10H22 dekana
 |
| Alkana |
Isomeri adalah senyawa-senyawa yang mempunyai rumus molekul sama (jumlah atom c sama) tetapi rumus strukturnya berbeda. sebagai contoh yang paling mudah yaitu pentana yang memiliki dua isomeri yaitu normal butana (n-butana) dan isobutana. Semakin banyak jumlah atom C maka akan semakin banyak isomerinya.
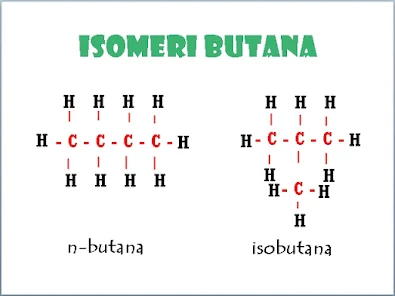 |
| Isomeri Butana |
Gugus Alkil adalah gugus yang terbentuk karena salah satu atom hidrogen dalam alkana diganti dengan unsur atau senyawa lain. Gugus alkil memiliki rumus umum CnH2n+1
Tatanama senyawa alkana
1. Senyawa alkana dinamai berdasarkan rantai C yang terpanjang. Jika terdapat dua atu lebih rantai terpanjang, maka dipilih yang memiliki cabang terbanyak.
2. Cabang yang terikat pada rantai induk disebut gugus alkil.
3. Atom c ujung yang paling dekat dengan gugus alkil diberi nomor 1 lalu selanjutnya berurutan sampai ujung yang lain.
4. Jika terdapat dua atau lebih alkil yang sama maka cukup ditulis satu kali dengan diberi awalan di, tri, tetra, penta dan seterusnya.
5. Cabang-cabang alkil ditulis dengan urutan alafabet. Misalnya ada cabang metil dan etil maka tulis etil lebih dahulu.
 |
| dimetil heptana |
Sifat-sifat alkana
Sifat fisis
Makin panjang rantai karbon senyawa alkana makin tinggi titik leleh, titik didih dan massa jenisnya. Alkana dengan isomer bercabang mempunyai titik leleh dan titik didih lebih rendah.
Empat suku pertama (metana, etana, propana dan butana) berfase gas, suku ke-5 sampai 14 berfase cair, dan suku ke 18 ke atas bersifat padat. Semua alkana sukar larut dalam air.
Sifat kimia
Alkana tergolong zat yang sukar bereaksi (afinitasnya kecil), sehingga disebut juga parafin. Tapi alkana mengalami reaksi pembakaran. Pada pembakaran sempurna senyawa hidrokarbon menghasilkan gas karbon dioksida dan uap air.
Alkana juga dapat mengalami cracking yaitu pemanasannya pada suhu dan tekanan tinggi tanpa oksigen dapat menyebabkan pemutusan rantai atau pembentukan senyawa yang tidak jenuh.
ALKENA
Alkena adalah senyawa hidrokarbon alifatik tak jenuh yang rantainya memiliki ikatan rangkap dua (-C=C-) . Alkena memiliki rumus umum CnH2n
Jumlah atom C Rumus Molekul Nama Alkena
- - -
- C2H4 etena
- C3H6 propena
- C4H8 butena
- C5H10 pentena
- C6H12 heksena
- C7H14 heptena
- C8H16 oktena
- C9H18 nonena
- C10H20 dekena
Tatanama senyawa alkena
1. Nama alkena diturunkan dari nama alkana dengan jumlah atom C sama hanya mengganti akhiran ana menjadi ena.
2. Rantai utama dipilih rantai terpanjang yang memiliki ikatan rangkap.
3. Atom C terdekat dengan ikatan rangkap diberi nomor 1, 2, 3, dan seterusnya.
4. Posisi ikatan rangkap ditunjukkan dengan angka di depan rantai alkena.
5. Penulisan cabang/alkil sama seperti alkana
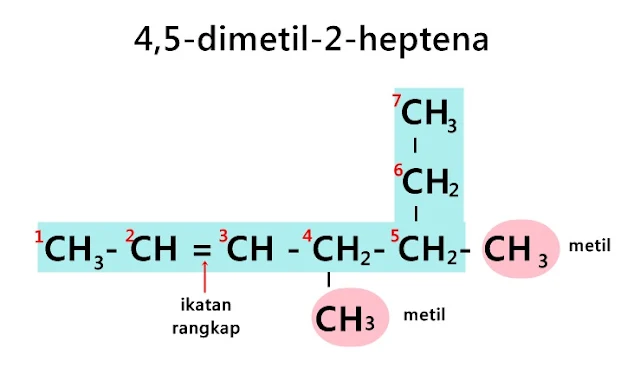 |
| heptena |
Sifat-sifat alkena
Sifat fisis
Makin banyak jumlah atom C makin tinggi titik leleh dan titik didihnya. Pada suhu kamar, suku-suku rendah (atom C sedikit) berwujud gas, suku-suku sedang berwujud cair dan suku-suku tinggi berwujud padat.
Sifat kimia
Akibat adanya ikatan rangkap (tak jenuh) maka alkena lebih reaktif dibanding alkana. Alkena dapat mengalami reaksi adisi (penambahan), dan reaksi polimerisasi (penggabungan monomer menjadi polimer0. Selain itu, alkena juga mudah terbakar, seperti juga alkana yang menghasilkan gas karbon dioksida dan uap air.
Isomer geometris
Rumus molekul dan rumus struktur sama, tetapi berbeda susunan ruang atomnya dalam molekul yang dibentuknya.
 |
| Isomer Geometris |
ALKUNA
Alkuna adalah senyawa hidrokarbon alifatik tak jenuh yang rantainya memiliki ikatan rangkap tiga (-C≡C-) . Alkuna memiliki rumus umum CnH2n-2
Jumlah atom C Rumus Molekul Nama Alkuna
- - -
- - -
- C3H4 propuna
- C4H6 butuna
- C5H8 pentuna
- C6H10 heksuna
- C7H12 heptuna
- C8H14 oktuna
- C9H16 nonuna
- C10H18 dekuna
 |
| alkuna |
Tatanama senyawa alkuna
1. Nama alkuna diturunkan dari nama alkana dengan jumlah atom C sama hanya mengganti akhiran ana menjadi una.
2. Rantai utama dipilih rantai terpanjang yang memiliki ikatan rangkap.
3. Aturan lainnya sama dengan alkena
Sifat-sifat alkena
Sifat fisis Alkuna hampir sama dengan alkana dan alkena, sedangkan sifat kimia alkuna mirip dengan alkena. Untuk menjenuhkan ikatan rangkap alkuna dibutuhkan pereaksi dua kali lebih banyak dibandingkan alkena.
REAKSI-REAKSI PADA HIDROKARBON
Reaksi pembakaran
Hidrokarbon ketika dibakar maka akan menghasilkan gas karbondioksida dan uap air. Berikut contoh reaksi pembakaran pada butana (alkana), butena (alkena) dan butuna (alkuna).
Butana
C4H10 + 6,5O2 ⇨ 4CO2 + 5H2OButena
C4H8 + 6O2 ⇨ 4CO2 + 4H2OButuna
C4H6 + 5,5O2 ⇨ 4CO2 + 3H2O
Reaksi penambahan (adisi)
Reaksi ini hanya bisa terjadi pada senyawa tak jenuh (rangkap). Pada reaksi adisi, ikatan rangkap dijenuhkan.
Adisi hidrogen pada propena
CH2=CH-CH3 + H2 ⇨ CH3-CH2-CH3Propena dijenuhkan oleh gas hidrogen menjadi propana
Adisi klorin pada propena
CH2=CH-CH3 + Cl2 ⇨ CH2Cl-CHCl-CH3Propena dijenuhkan oleh gas klorin menjadi 1,2-dikloropropana


